來源:中國醫(yī)藥報(bào) ?
2017年07月24日 發(fā)布 ?
?
2015年,一個(gè)對中國藥品監(jiān)管來說不同尋常的年份。
?
當(dāng)年7月,國家食品藥品監(jiān)督管理總局發(fā)布《關(guān)于開展藥物臨床試驗(yàn)數(shù)據(jù)自查核查工作的公告》(2015年第117號(hào))。10月末,第一批臨床試驗(yàn)數(shù)據(jù)核查員奔赴藥物臨床試驗(yàn)機(jī)構(gòu)開展數(shù)據(jù)核查。從此,我國藥品監(jiān)管與國際接軌,藥物創(chuàng)新研發(fā)步入嶄新時(shí)代,全世界的目光被中國的這一改革所吸引。中國13億人民用藥安全的殷殷期盼在一代食藥監(jiān)人大無畏的改革中變?yōu)楝F(xiàn)實(shí)……
?
7月21日,國家食品藥品監(jiān)督管理總局審核查驗(yàn)中心(以下簡稱核查中心)發(fā)布《藥物臨床試驗(yàn)數(shù)據(jù)核查階段性報(bào)告》(以下簡稱報(bào)告),總結(jié)回顧開展藥物臨床試驗(yàn)數(shù)據(jù)核查兩周年的歷程。
?
報(bào)告顯示,國家食品藥品監(jiān)督管理總局開展藥物臨床試驗(yàn)數(shù)據(jù)核查兩年來,共派出185個(gè)檢查組,對313個(gè)藥品注冊申請進(jìn)行現(xiàn)場核查,整肅了我國藥品研發(fā)領(lǐng)域不規(guī)范行為,營造出科學(xué)、公平的創(chuàng)新研發(fā)環(huán)境,圓滿完成了總局向國家和人民承諾的階段性任務(wù)。
?
歷史呼喚 敢為人先
?
時(shí)間回到2015年。
?
2015年5月29日,習(xí)近平總書記在中共中央政治局第二十三次集體學(xué)習(xí)時(shí)對食品藥品安全工作做出重要指示,要求用“最嚴(yán)謹(jǐn)?shù)臉?biāo)準(zhǔn)、最嚴(yán)格的監(jiān)管、最嚴(yán)厲的處罰、最嚴(yán)肅的問責(zé),確保廣大人民群眾飲食用藥安全”……而彼時(shí),擺在食藥監(jiān)系統(tǒng)面前最亟待解決的問題就是保障每一個(gè)審批上市的藥品安全有效,護(hù)佑人民的健康。2015年8月9日,國務(wù)院下發(fā)《關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》(國發(fā)〔2015〕44號(hào)),要求“嚴(yán)肅查處注冊申請弄虛作假行為。加強(qiáng)臨床試驗(yàn)全過程監(jiān)管,確保臨床試驗(yàn)數(shù)據(jù)真實(shí)可靠”。
?
眾所周知,我國是仿制藥生產(chǎn)大國,醫(yī)藥產(chǎn)業(yè)經(jīng)過30年的高速發(fā)展,醫(yī)藥工業(yè)總產(chǎn)值已經(jīng)突破2.8萬億元,成為全球第二大醫(yī)藥市場。然而,在滿足了13億人口的基本臨床用藥可及性后,我國藥品生產(chǎn)結(jié)構(gòu)性問題也日益突出,即仿制藥同質(zhì)化嚴(yán)重、低水平重復(fù)、創(chuàng)新研發(fā)基礎(chǔ)薄弱,亟待從制藥大國向制藥強(qiáng)國轉(zhuǎn)變,而作為創(chuàng)新研發(fā)重要的一環(huán)——臨床試驗(yàn)數(shù)據(jù)檢查過去從未開展過。
?
對于開展臨床數(shù)據(jù)核查的意義,核查中心主任丁建華說:“過去,我國醫(yī)藥產(chǎn)業(yè)水平較低,監(jiān)管注重認(rèn)證與檢驗(yàn),目標(biāo)是強(qiáng)基礎(chǔ)。由于藥品質(zhì)量責(zé)任主體不清晰,一些企業(yè)在認(rèn)證完成后不能堅(jiān)持標(biāo)準(zhǔn),被查出很多問題。近兩年,我國藥品監(jiān)管理念發(fā)生重大變化,逐步與國際接軌,持續(xù)開展藥品全生命周期檢查,將檢查作為監(jiān)管的重要手段,收到較好效果。臨床試驗(yàn)數(shù)據(jù)的真實(shí)、科學(xué)、可靠是藥物審評審批的重要基礎(chǔ),也是開展技術(shù)審評的基本保證,開展臨床試驗(yàn)數(shù)據(jù)核查是從藥品研發(fā)源頭遏制企業(yè)急功近利、弄虛作假行為,推動(dòng)藥品審評審批制度改革。
?
按照總局向國務(wù)院的承諾,到2017年6月30日,我國藥品臨床試驗(yàn)數(shù)據(jù)核查要完成289個(gè)品種。2015年10月末,我國第一批臨床試驗(yàn)數(shù)據(jù)核查員悄然出發(fā),奔赴臨床基地開展核查。這看似小小的一步,卻是我國藥品監(jiān)管發(fā)展進(jìn)程中的一大步。總局局長畢井泉在“藥物臨床試驗(yàn)數(shù)據(jù)核查工作座談會(huì)”上指出,在臨床數(shù)據(jù)核查工作中,要嚴(yán)懲故意造假,要一把尺子量到底,決不能前緊后松,決不能讓“老實(shí)人”吃虧。要通過對極少數(shù)臨床數(shù)據(jù)造假責(zé)任人的處罰,警示和教育大多數(shù),重建藥品研發(fā)生態(tài),促進(jìn)制藥行業(yè)健康發(fā)展,確保公眾用藥有效安全。
?
戰(zhàn)鼓已經(jīng)擂響。歷史的使命,改革的呼喚,讓食藥監(jiān)人義無反顧地踏上了充滿荊棘之路。
?
迎難而上 砥礪前行
?
“當(dāng)接到開展臨床數(shù)據(jù)核查任務(wù)時(shí),我們只有15名檢查員。”核查中心研究核查處相關(guān)負(fù)責(zé)人回憶,在開展核查最初的日子里,高負(fù)荷的工作令每一名參與者都像是上緊了發(fā)條不停地旋轉(zhuǎn)。
?
人手不夠,核查中心就向全國各相關(guān)機(jī)構(gòu)發(fā)出“英雄帖”,經(jīng)過嚴(yán)格招聘,在最短的時(shí)間內(nèi)建立了檢查員庫,一大批具有專業(yè)背景和研究經(jīng)驗(yàn)的人員充實(shí)到檢查一線崗位。這些檢查員均具有臨床試驗(yàn)相關(guān)的資質(zhì)和經(jīng)驗(yàn),并經(jīng)過系統(tǒng)性培訓(xùn)和考核,專業(yè)背景涵蓋臨床醫(yī)學(xué)、生物統(tǒng)計(jì)、生物分析、公共衛(wèi)生等。目前共有500余名檢查員參加了現(xiàn)場核查工作,檢查員來自于核查中心、中檢院、藥審中心、藥典委、各省局、各大專院校及醫(yī)療機(jī)構(gòu)。此外,核查中心還建立了外部檢查員選擇和使用管理辦法,對核查工作的保密性、獨(dú)立性和利益沖突等進(jìn)行管理。為加強(qiáng)檢查員的廉政意識(shí),每次檢查前核查中心都對檢查組進(jìn)行集中培訓(xùn),統(tǒng)一標(biāo)準(zhǔn)和認(rèn)識(shí)。一名放棄高薪的外企白領(lǐng)在參加招聘時(shí)坦言,“檢查員工作神圣,我想用自己的專業(yè)知識(shí)保護(hù)每一位親人的用藥安全。”
?
臨床試驗(yàn)數(shù)據(jù)核查工作社會(huì)關(guān)注度極高,稍有不慎就有可能被置于輿論的風(fēng)口浪尖,因此,建立科學(xué)、嚴(yán)謹(jǐn)?shù)臋z查程序極為關(guān)鍵。為此,核查中心在檢查員培訓(xùn)、現(xiàn)場檢查準(zhǔn)備、現(xiàn)場檢查實(shí)施、檢查結(jié)果報(bào)告、檢查資料存檔等環(huán)節(jié)都制定了工作程序,并對現(xiàn)場核查過程進(jìn)行質(zhì)量監(jiān)控。
?
制定現(xiàn)場核查計(jì)劃。藥審中心根據(jù)審評進(jìn)度和評價(jià)需要,向核查中心提供需要核查的品種情況。核查中心按審評順序、自查報(bào)告填報(bào)情況以及舉報(bào)信息等情況擬定現(xiàn)場核查計(jì)劃。
?
核查計(jì)劃公示。從2016年3月至2017年6月底,共發(fā)布藥物臨床試驗(yàn)數(shù)據(jù)現(xiàn)場核查計(jì)劃公示12期351個(gè)品種,公示期為10個(gè)工作日,在公示后10個(gè)工作日內(nèi)未提出撤回申請的視為接受現(xiàn)場核查。
?
開展現(xiàn)場核查。檢查組根據(jù)《藥物臨床試驗(yàn)數(shù)據(jù)現(xiàn)場核查要點(diǎn)》(2015年第228號(hào)公告)進(jìn)行核查,確保各組間尺度一致。根據(jù)注冊申請類型,對Ⅱ/Ⅲ期臨床試驗(yàn)平均檢查試驗(yàn)場點(diǎn)4個(gè),平均檢查時(shí)間7天;生物等效性試驗(yàn)檢查臨床部分與生物樣本分析部分,平均檢查天數(shù)4天。
?
集中會(huì)審。核查中心建立了由臨床醫(yī)學(xué)、藥學(xué)、生物分析、醫(yī)學(xué)檢驗(yàn)、醫(yī)學(xué)統(tǒng)計(jì)、醫(yī)學(xué)倫理等各專業(yè)專家組成的委員會(huì),采用盲審的方式對核查結(jié)果進(jìn)行集中會(huì)審,確保會(huì)審結(jié)果客觀公正。
?
反饋溝通核查情況。集中會(huì)審后,核查中心向藥品注冊申請人和主要研究者反饋和溝通核查情況。如有異議可進(jìn)一步提交資料,申請二次會(huì)審。截至2017年6月底,共組織召開溝通會(huì)14次,參會(huì)人員超過920人次,答疑近500條。
?
核查意見轉(zhuǎn)藥審中心。綜合核查意見與溝通情況,核查中心形成明確的核查意見,隨相關(guān)材料轉(zhuǎn)藥審中心進(jìn)行綜合審評。從現(xiàn)場核查開始到核查意見轉(zhuǎn)藥審中心的平均時(shí)間為24個(gè)工作日。
?
“數(shù)據(jù)核查是國家食藥監(jiān)部門通過行政手段,以最嚴(yán)謹(jǐn)?shù)臉?biāo)準(zhǔn),最嚴(yán)格的監(jiān)管,最嚴(yán)厲的處罰,最嚴(yán)肅的問責(zé)來保證藥品質(zhì)量和國民的用藥安全。數(shù)據(jù)核查重創(chuàng)了國內(nèi)部分藥企急功近利的違規(guī)行為,同時(shí)食藥監(jiān)部門建立起了更加完善明確的審查要求和質(zhì)量規(guī)范,對創(chuàng)新藥的研發(fā)進(jìn)一步明確了審評審批的具體要求,這些嚴(yán)謹(jǐn)、科學(xué)、透明的審批尺度,有力地保障了創(chuàng)新藥研發(fā)的生態(tài)環(huán)境,也提高了企業(yè)對創(chuàng)新藥研發(fā)的積極性。”泰德制藥研發(fā)相關(guān)負(fù)責(zé)人說。
?
石藥集團(tuán)研發(fā)助理總裁王榮瑞說,臨床數(shù)據(jù)核查在全行業(yè)營造了公平、規(guī)范、科學(xué)的創(chuàng)新研發(fā)環(huán)境,企業(yè)的創(chuàng)新勁頭越來越足。
?
有條件要上,沒有條件創(chuàng)造條件也要上。在改革者面前,任何困難都將被強(qiáng)大的信念和無畏的行動(dòng)所征服。中國藥物創(chuàng)新研發(fā)雖起步艱難,但前景美好!
?
助力創(chuàng)新 走向國際
?
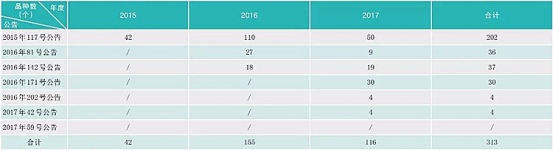
總局開展臨床試驗(yàn)數(shù)據(jù)核查兩年來,取得的成績有目共睹:徹底扭轉(zhuǎn)了我國藥品研發(fā)領(lǐng)域的浮夸風(fēng)氣,尊重科學(xué)、崇尚真實(shí)的氛圍正在形成,向黨和人民交上了一份滿意的階段性答卷。截止到2017年6月底,核查中心共派出檢查組185個(gè),組織檢查員1635人次,對313個(gè)已提交自查資料的藥品注冊申請進(jìn)行了臨床試驗(yàn)數(shù)據(jù)現(xiàn)場核查,其中,新藥注冊申請94個(gè),仿制藥注冊申請37個(gè),進(jìn)口藥注冊申請182個(gè)。核查藥物臨床試驗(yàn)機(jī)構(gòu)763家次,生物樣本分析單位121家次,分布于全國28個(gè)省、自治區(qū)和直轄市(見下表)。
?
?
藥物臨床試驗(yàn)數(shù)據(jù)核查工作進(jìn)度
?
“開展數(shù)據(jù)核查對于醫(yī)藥企業(yè)的創(chuàng)新質(zhì)量提升和國際接軌都有正面作用。”中國化學(xué)制藥工業(yè)協(xié)會(huì)執(zhí)行會(huì)長潘廣成介紹,近年來創(chuàng)新企業(yè)越來越多,一些企業(yè)到國外建廠或者做臨床試驗(yàn),他們越來越感到臨床數(shù)據(jù)真實(shí)性對創(chuàng)新研發(fā)和國際化的重要性。保持臨床數(shù)據(jù)的真實(shí)性和完整性將是企業(yè)做大做強(qiáng)、走向國際化的必由之路,創(chuàng)新企業(yè)和出口型企業(yè)在這方面體會(huì)更深。“一家企業(yè)曾反映,F(xiàn)DA到企業(yè)檢查的時(shí)候,不光要核查當(dāng)年的數(shù)據(jù),還要把前幾年的數(shù)據(jù)一并調(diào)出來檢查,看與企業(yè)的申報(bào)是否一致。”潘廣成說。
?
他介紹,協(xié)會(huì)近些年也一直從軟件和硬件上推動(dòng)企業(yè)重視數(shù)據(jù)的真實(shí)性。“我們一方面推動(dòng)企業(yè)從意識(shí)上重視數(shù)據(jù)真實(shí)性和完整性,一方面從硬件上推動(dòng)設(shè)備自動(dòng)化和信息化的結(jié)合,后者在數(shù)據(jù)記錄上減少了人為干預(yù)的概率,有利于減少數(shù)據(jù)造假的發(fā)生。”
?
開展臨床試驗(yàn)數(shù)據(jù)核查兩年來,我國藥物創(chuàng)新研發(fā)進(jìn)入嶄新階段,臨床試驗(yàn)數(shù)據(jù)真實(shí)、科學(xué)蔚然成風(fēng),從“7·22”醫(yī)藥企業(yè)面對核查無信心地大面積撤回仿制藥注冊申請,到目前企業(yè)創(chuàng)新立項(xiàng)謹(jǐn)慎、臨床申報(bào)謹(jǐn)慎、仿制藥注冊申請撤回率大大降低,臨床數(shù)據(jù)核查像一股強(qiáng)勁之風(fēng),將盤踞于新藥研發(fā)領(lǐng)域的沉疴頑疾蕩滌一新。
?
過去兩年,羅氏申報(bào)了3個(gè)臨床試驗(yàn)品種,這三個(gè)品種先后成功通過總局臨床數(shù)據(jù)核查。“羅氏公司欣喜地看到兩年來CFDA取得的成績,檢查工作公開透明,核查人員業(yè)務(wù)能力不斷提高,檢查工作規(guī)范性和統(tǒng)一性不斷提升。我們認(rèn)為,開展臨床數(shù)據(jù)核查是對中國醫(yī)藥企業(yè)的重大利好,既有利于凈化醫(yī)藥研發(fā)的‘生態(tài)環(huán)境’,促進(jìn)研發(fā)水平提升,又促進(jìn)了國內(nèi)新藥和仿制藥走出國門。隨著與國際接軌的核查標(biāo)準(zhǔn)不斷完善提高,對國內(nèi)研究機(jī)構(gòu)和研究者也提出了更高的要求,只有經(jīng)過科學(xué)和嚴(yán)謹(jǐn)?shù)难芯框?yàn)證過的藥物,才能真正惠及中國患者。”羅氏公司亞太區(qū)注冊負(fù)責(zé)人呂玉真說。
?
記者了解到,開展臨床試驗(yàn)數(shù)據(jù)核查以來,醫(yī)藥企業(yè)、臨床機(jī)構(gòu)更為重視試驗(yàn)細(xì)節(jié),加強(qiáng)了臨床試驗(yàn)的監(jiān)督力度,數(shù)據(jù)真實(shí)性、規(guī)范性得到大幅提升。與此同時(shí),總局推出一系列政策破解臨床試驗(yàn)資源不足等難題。
?
一家大型中藥企業(yè)研發(fā)負(fù)責(zé)人表示,我們的一個(gè)產(chǎn)品正在美國做臨床試驗(yàn),一個(gè)病例要花費(fèi)5萬美元,我們不怕花錢,怕的就是花了錢臨床試驗(yàn)不客觀、有水分。總局開展臨床試驗(yàn)數(shù)據(jù)核查后,臨床機(jī)構(gòu)的重視程度大幅提高,能力水平得到了長足進(jìn)步。我們支持總局的改革,我們希望臨床試驗(yàn)更規(guī)范一些,門檻更高一些,只有這樣,中國制造才能真正走向國際市場。
?
持續(xù)提升 改革到底
?
任何改革都非一蹴而就,關(guān)鍵是總結(jié)成績,改革到底。
?
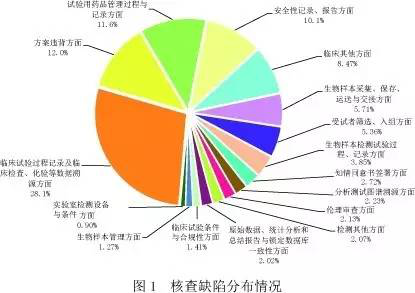
報(bào)告顯示,經(jīng)過對313個(gè)藥品注冊申請的現(xiàn)場核查報(bào)告進(jìn)行分析,共發(fā)現(xiàn)5111條缺陷項(xiàng)。其中臨床部分4583條,平均每個(gè)臨床試驗(yàn)機(jī)構(gòu)發(fā)現(xiàn)問題6條;生物分析部分528條,平均每個(gè)生物樣本分析單位發(fā)現(xiàn)問題4.4條。依據(jù)《藥物臨床試驗(yàn)數(shù)據(jù)現(xiàn)場核查要點(diǎn)》對缺陷進(jìn)行分類,發(fā)現(xiàn)缺陷條款數(shù)量最多的方面依次為:臨床試驗(yàn)過程記錄及臨床檢查、化驗(yàn)等數(shù)據(jù)溯源方面(占28.1%),方案違背方面(占12.0%),試驗(yàn)用藥品管理過程與記錄方面(占11.6%)和安全性記錄、報(bào)告方面(占10.1%),共發(fā)現(xiàn)缺陷3161項(xiàng),占61.8%(見圖1)。
?
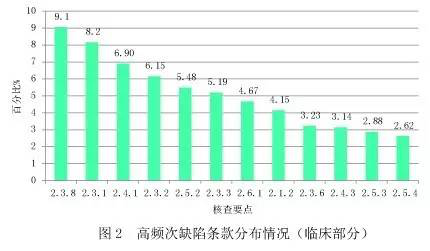
對臨床部分現(xiàn)場核查發(fā)現(xiàn)的4583項(xiàng)缺陷匯總分析,顯現(xiàn)出頻次最高的缺陷條款(見圖2)。
?
對分析測試部分現(xiàn)場核查發(fā)現(xiàn)的528項(xiàng)缺陷匯總分析,顯現(xiàn)出頻次最高的缺陷條款(見圖3)。

?
王榮瑞認(rèn)為,我國藥品生產(chǎn)質(zhì)量規(guī)范也走過了發(fā)展、成熟到完善的過程。因此,企業(yè)在臨床數(shù)據(jù)核查中遇到的問題都將在持續(xù)改革中逐漸解決。
?
今年5月,總局發(fā)布《關(guān)于鼓勵(lì)藥品醫(yī)療器械創(chuàng)新加快新藥醫(yī)療器械上市審評審批的相關(guān)政策》等四個(gè)征求意見稿,將藥品審評審批改革再次推向高潮。國家衛(wèi)計(jì)委科技司重大專項(xiàng)處處長顧金輝感嘆于國家總局在藥品審評審批改革中的巨大變化,稱“改革的速度和力度前所未有”。
?
江蘇恒瑞醫(yī)藥股份有限公司研發(fā)總監(jiān)朱林表示,總局重視研發(fā)監(jiān)管,特別是開展臨床試驗(yàn)數(shù)據(jù)核查以來,扭轉(zhuǎn)了研發(fā)領(lǐng)域“劣幣驅(qū)良幣”的狀態(tài),投機(jī)取巧的企業(yè)無法過關(guān),讓企業(yè)更放心地開展創(chuàng)新研發(fā)。經(jīng)過臨床試驗(yàn)數(shù)據(jù)核查,企業(yè)更加深刻理解了“研發(fā)最重要”幾個(gè)字的含義,“我們真心為改革叫好!”
?
“潮平兩岸闊,風(fēng)正一帆懸”。開展臨床試驗(yàn)數(shù)據(jù)核查兩年來,食藥監(jiān)人用實(shí)際行動(dòng)踐行習(xí)近平總書記“四個(gè)最嚴(yán)”的要求,為保障人民群眾用藥安全,在改革的道路上披荊斬棘,勇往直前。
?
?
文/中國醫(yī)藥報(bào)記者 方劍春